Exigences de tests de stabilité : conditions de température et de durée
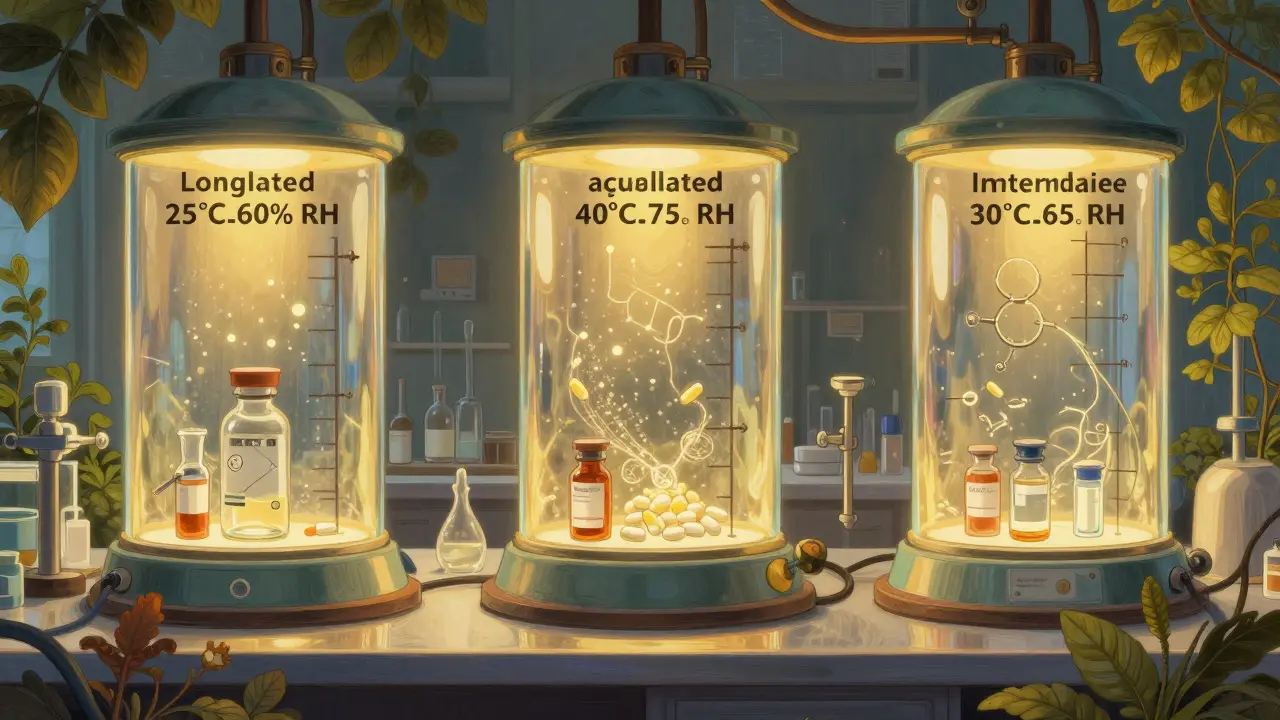 janv., 10 2026
janv., 10 2026
Les exigences de base pour les tests de stabilité en pharmacie
Quand un médicament quitte l’usine, il doit rester sûr et efficace pendant des mois, voire des années. Ce n’est pas un hasard. C’est le résultat de tests rigoureux appelés tests de stabilité. Ces tests mesurent comment un médicament se dégrade avec le temps sous l’effet de la chaleur, de l’humidité et de la lumière. Sans eux, des comprimés pourraient perdre leur puissance, des solutions injectables pourraient former des particules dangereuses, ou des gélules pourraient se dégrader avant la date de péremption. Les autorités sanitaires comme la FDA aux États-Unis ou l’EMA en Europe exigent ces tests avant d’autoriser un médicament sur le marché. Le cadre de référence mondial, établi par l’ICH (Conseil international de l’harmonisation), est le document ICH Q1A(R2), publié en 2003 et toujours en vigueur en 2026.
Les trois niveaux de tests : long terme, accéléré et intermédiaire
Les tests de stabilité ne se font pas à une seule température. Ils suivent trois protocoles distincts, chacun avec un objectif précis.
Le test long terme est le plus important. Il simule les conditions réelles de stockage. Pour les médicaments stockés à température ambiante, deux options sont possibles : 25°C ± 2°C avec 60% d’humidité relative ou 30°C ± 2°C avec 65% d’humidité relative. Le choix dépend du climat du pays où le médicament sera vendu. Les pays chauds et humides, comme ceux de la zone IV de l’ICH, exigent le test à 30°C/65% RH. La durée minimale requise à l’inscription d’un dossier est de 12 mois aux États-Unis, mais l’EMA permet parfois 6 mois si le dossier est complet sur d’autres points. Les échantillons sont analysés à 0, 3, 6, 9, 12, 18, 24 et 36 mois.
Le test accéléré pousse les conditions à l’extrême pour prédire la dégradation future. Il se fait à 40°C ± 2°C et 75% d’humidité relative pendant 6 mois. C’est une épreuve de stress. Si le médicament résiste à ces conditions, on estime qu’il durera au moins 2 ans à 25°C. Cette méthode est utilisée partout dans le monde, de New York à Shanghai, car elle est harmonisée par l’ICH.
Le test intermédiaire est un point d’interrogation. Il n’est fait que si le test accéléré montre un changement important et que le test long terme est fait à 25°C. Il se déroule à 30°C ± 2°C et 65% d’humidité relative pendant 6 mois. Il permet de comprendre pourquoi le médicament se dégrade et d’ajuster les conditions de stockage.
Les médicaments réfrigérés : un autre monde
Tous les médicaments ne sont pas stockés à température ambiante. Les vaccins, les insulines, les anticorps monoclonaux - les biologiques - doivent être conservés au froid. Pour eux, les règles changent.
Le test long terme se fait à 5°C ± 3°C pendant 12 mois. Le test accéléré, lui, n’est pas à 40°C. Il est à 25°C ± 2°C et 60% d’humidité relative pendant 6 mois. C’est crucial. Une insuline exposée à 40°C peut se dégrader instantanément, alors qu’à 25°C, la dégradation est plus lente et plus réaliste. L’OMS et l’ICH l’ont bien compris. Si un fabricant teste un médicament réfrigéré à 40°C, les résultats sont invalides. Les chambres de stockage doivent être calibrées pour maintenir une température stable à ±0,5°C près. Une variation de 2°C pendant une nuit peut fausser tout un essai.
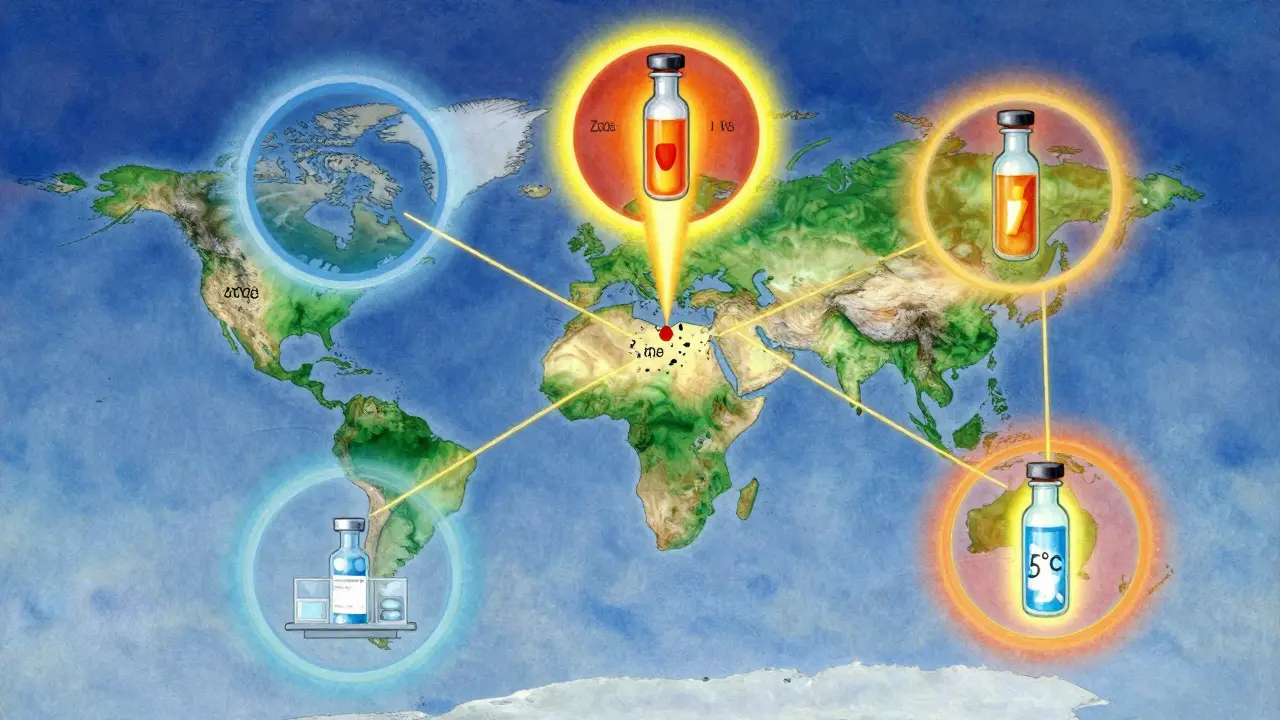
Les zones climatiques et les défis mondiaux
Un médicament vendu en France ne sera pas stocké comme celui vendu en Inde ou au Brésil. L’ICH a divisé le monde en cinq zones climatiques. La zone I (tempérée, comme l’Europe du Nord) exige 21°C/45% RH. La zone II (Méditerranée, Asie du Sud-Est) exige 25°C/60% RH. La zone IVa (tropicale, comme l’Afrique de l’Ouest ou le Sud-Est asiatique) exige 30°C/65% RH. La zone IVb (tropicale très humide) exige même 30°C/75% RH.
Cela signifie qu’un même médicament peut avoir besoin de trois protocoles de stabilité différents pour être vendu partout. Une entreprise qui veut lancer un produit dans les pays tropicaux doit faire des tests supplémentaires. Cela ajoute 4 à 6 mois au calendrier de développement. Pour les petites entreprises, c’est un coût énorme. Certains fabricants choisissent de ne commercialiser que dans les zones les plus faciles. D’autres investissent dans des chambres multi-zones, mais elles coûtent jusqu’à 100 000 euros chacune.
Les pièges courants et les erreurs coûteuses
Les tests de stabilité sont répétitifs, mais ils ne laissent aucune place à l’erreur. Les erreurs les plus fréquentes sont souvent liées à la logistique, pas à la science.
- Les chambres de stockage ne sont pas bien cartographiées. La température peut varier de ±1,8°C entre les étagères du haut et du bas. Un échantillon placé près d’une porte peut être exposé à des pics de chaleur chaque fois qu’on l’ouvre.
- L’humidité n’est pas contrôlée. Dans les régions sèches, les chambres doivent avoir des systèmes d’humidification. Sans eux, l’humidité relative peut tomber à 30% au lieu de 60%, faussant les résultats.
- Les défaillances de température sont sous-estimées. Selon une enquête de 2023 sur LinkedIn, 78% des laboratoires ont connu au moins un accident de température pendant une étude de 12 mois. Un seul incident peut invalider toute une étude.
- Le terme « changement significatif » est vague. L’ICH ne définit pas précisément ce qu’il faut. Une baisse de 4,8% de la concentration active peut sembler négligeable, mais si elle dépasse la limite de spécification (ex. : 95-105%), l’agence régulatrice peut bloquer le lancement. Des rappels de médicaments, comme celui de Teva en 2021 pour son générique Copaxone®, ont été causés par des défaillances non détectées à cause de cette ambiguïté.

Les nouvelles tendances et l’avenir des tests
Le cadre ICH Q1A(R2) a 20 ans. Il a été conçu pour les comprimés classiques. Il ne s’adapte pas bien aux nouvelles technologies comme les nanoparticules lipidiques des vaccins mRNA ou les anticorps conjugués (ADC).
Les experts disent que les protocoles actuels ne capturent pas les dégradations causées par les cycles de congélation-décongélation, ou les variations d’humidité dans les emballages. L’AAPS a montré que 62% des défaillances de stabilité des comprimés viennent de cycles d’humidité, pas d’une humidité constante.
La FDA teste actuellement des méthodes plus rapides. Avec la technologie PAT (Analyse du Processus en Temps Réel), elle essaie de prédire la stabilité à partir de données de fabrication. Si ça marche, les tests de 12 mois pourraient être réduits à 3 ou 4 mois pour certains produits. Des entreprises comme Merck utilisent déjà des modèles prédictifs avec des températures jusqu’à 80°C pour accélérer les tests. Mais l’EMA rejette encore 8 demandes sur 10 basées uniquement sur des modèles - il faut encore des données physiques.
En 2024, l’ICH devrait publier une mise à jour : Q1F. Elle devrait intégrer les exigences pour les thérapies avancées. Pour l’instant, les fabricants de biologiques doivent faire des tests plus longs, plus chers, et souvent avec des protocoles personnalisés. C’est le coût de l’innovation.
Combien ça coûte, et qui le fait ?
Un programme complet de tests de stabilité pour un nouveau médicament coûte entre 185 000 et 275 000 euros. Pour une petite entreprise, c’est presque autant que le budget annuel de recherche. C’est pourquoi 65% des startups externalisent ces tests à des CRO (contract research organizations) comme WuXi AppTec ou Charles River Laboratories.
Les grandes entreprises comme Roche ou Novartis ont leurs propres laboratoires de stabilité, avec des chambres climatiques de plusieurs mètres de haut, contrôlées par des logiciels. Les techniciens qui les gèrent doivent avoir une formation en chimie, en statistiques (ANOVA, régression) et en réglementation. Il faut 6 à 9 mois pour apprendre à faire ça correctement.
Le marché mondial des tests de stabilité vaut 2,8 milliards d’euros en 2026 et croît à 6,7% par an. Ce n’est pas un luxe. C’est une exigence légale. Et chaque euro dépensé dans un bon test de stabilité évite un rappel de médicament, une perte de confiance des patients, ou une amende de l’agence régulatrice.
Que faut-il retenir ?
Les conditions de température et de durée pour les tests de stabilité ne sont pas des recommandations. Ce sont des règles impératives. 25°C/60% RH, 40°C/75% RH, 5°C - ces chiffres ne sont pas choisis au hasard. Ils sont basés sur des décennies de recherche et des milliers d’essais échoués.
Si vous travaillez dans la pharmacie, que vous soyez chercheur, ingénieur ou contrôleur qualité, vous devez les connaître par cœur. Un seul échantillon mal stocké peut faire échouer un lancement entier. Les grandes entreprises n’ont pas de marge d’erreur. Les petites non plus. La stabilité n’est pas un service annexe. C’est la colonne vertébrale de la sécurité du médicament.
Quelles sont les conditions de température et d’humidité pour un test de stabilité long terme standard ?
Pour les médicaments stockés à température ambiante, deux conditions sont acceptées selon l’ICH Q1A(R2) : soit 25°C ± 2°C avec 60% d’humidité relative ± 5%, soit 30°C ± 2°C avec 65% d’humidité relative ± 5%. Le choix dépend du climat du marché cible. Les pays chauds et humides utilisent la deuxième option.
Pourquoi le test accéléré se fait-il à 40°C et 75% d’humidité ?
Ces conditions sont conçues pour simuler des stress extrêmes, comme des expéditions en été ou des entrepôts mal contrôlés. À 40°C et 75% RH, la dégradation chimique s’accélère de manière prévisible. Six mois à ces conditions équivalent approximativement à deux ans à 25°C pour 85% des médicaments classiques. C’est une méthode standardisée pour prédire la durée de vie du produit.
Les médicaments réfrigérés suivent-ils les mêmes règles ?
Non. Pour les médicaments réfrigérés, le test long terme se fait à 5°C ± 3°C pendant 12 mois. Le test accéléré est à 25°C ± 2°C et 60% d’humidité relative - pas à 40°C. Une exposition à 40°C peut détruire des protéines ou des vaccins. Les conditions sont adaptées à la nature sensible de ces produits.
Qu’est-ce qu’un « changement significatif » dans les tests de stabilité ?
C’est un terme ambigu dans l’ICH Q1A(R2). Il signifie généralement : une baisse de plus de 5% de la concentration active, une apparition de nouveaux impuretés au-delà des seuils autorisés, ou une modification de l’apparence physique (couleur, texture, dissolution). Mais il n’y a pas de seuil universel. Chaque agence peut interpréter différemment. C’est une source fréquente de conflits avec les autorités.
Pourquoi les tests de stabilité prennent-ils tant de temps ?
Parce que la dégradation est un processus lent. Pour prédire la durée de vie d’un médicament sur 2 ou 3 ans, il faut observer son comportement pendant au moins 12 à 24 mois. Même avec des tests accélérés, les données long terme sont obligatoires pour la validation réglementaire. Il n’existe pas encore de méthode fiable pour remplacer entièrement le temps réel.